联系我们
010-69739712

近年来,CAR-T疗法在血液瘤治疗方面表现出令人鼓舞的结果,2017年美国FDA批准了两款CAR-T细胞产品上市,极大地鼓舞了细胞免疫治疗研发热情,CAR-T疗法在某些血液肿瘤中具有显著的疗效,并预示着肿瘤治疗模式的变革。CAR-T细胞疗法在其它恶性肿瘤方面也进行了深入的研究,部分产品已开展了早期临床试验,以评估CAR-T细胞的安全性和有效性。FDA规定CAR-T细胞临床试验样品必须经IND批准在GMP条件下生产。
GMP法规见美国Federal Regulations第21篇的各个章节。它们涵盖各种产品的制造,包括食品、小分子药物等。CAR-T最相关的章节在第210和211部分中介绍,在FDA指南“CGMP for Phase I Investigational Drugs”中简要介绍了用于早期临床试验的生产要求。讨论的关键领域如表1所示,其中包括一个专门的章节,涵盖与细胞和基因治疗产品相关的问题。
表1 FDA关于药物临床I期CGMP指南主要内容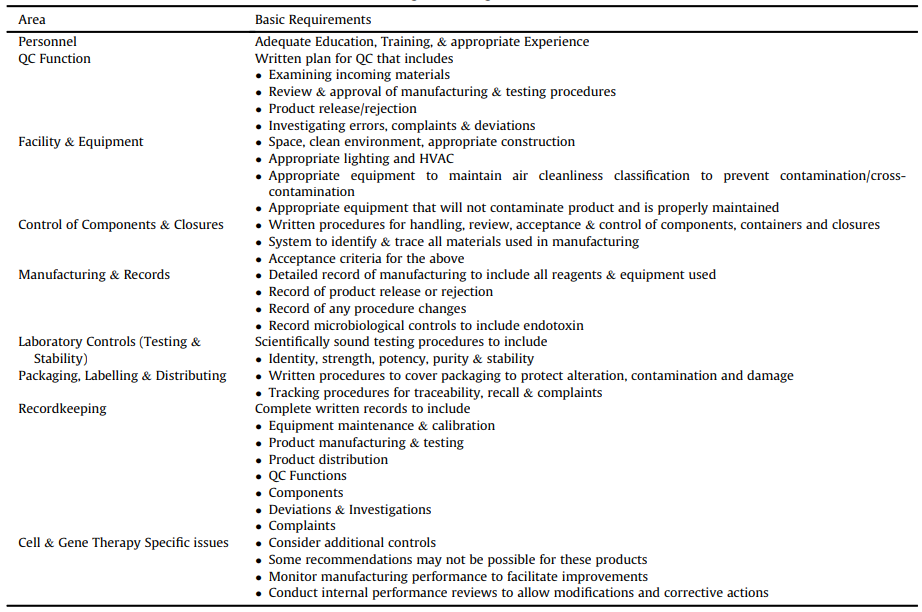
用于制造、加工或包装CAR-T的任何建筑或设施应具有适当的尺寸、位置,并采用适当的洁净室级材料建造,以确保适当的清洁、维护和生产操作。制造设施中的每个指定工作区域必须有适当的空间供设备、材料和人员移动,以防止不同部件、过程中材料或不同CAR-T产品之间的混合,从而有助于防止污染。如果使用多产品制造设施,则需要进行适当的交叉污染研究验证。
CAR-T细胞治疗产品、病毒载体和质粒的生产应当分别在各自独立的生产区域进行,并配备独立的空调净化系统。采用密闭设备、管路进行细胞治疗产品的生产操作;密闭设备、管路安置环境的洁净度级别可适当降低。同一生产区域有多条相同的生产线,且采用隔离器的,每个隔离器应当单独直接排风。细胞治疗产品、病毒载体、质粒的生产操作环境的洁净度级别,可参照表格中的示例进行选择。
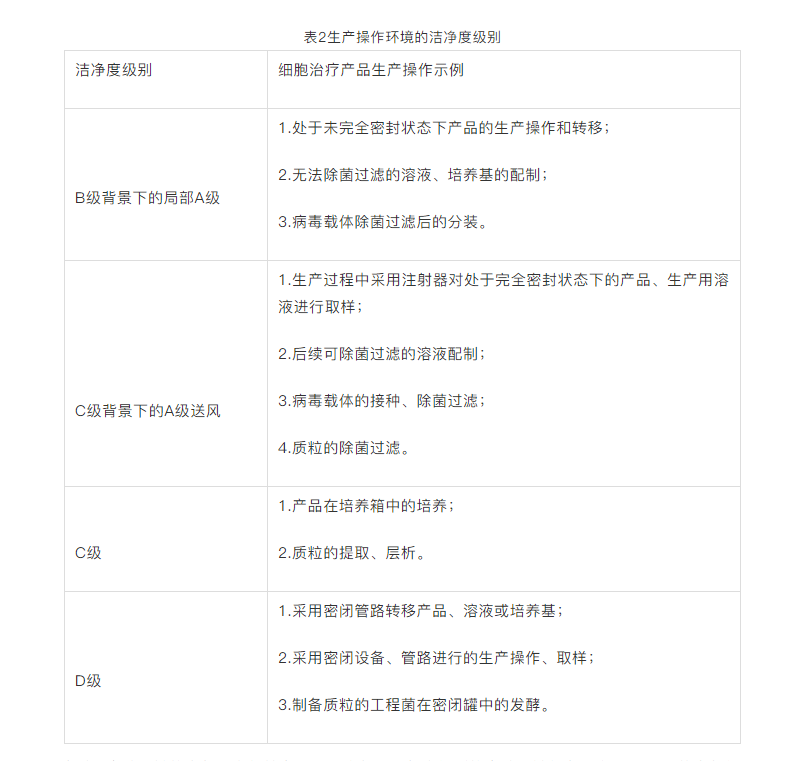
每个B实验区域的空气压力保持在+50Pa大气压,每个级别的实验区域都有一个10-15Pa的空气级联,没有空气再循环;新鲜空气通过终端Hepa过滤器进入每个实验区域,并通过低水平抽风器排出。换气速率从B实验区的70ac/H到D实验区的28ac/H不等。每个II类微生物安全柜和提供A级环境的QUBE隔离器都进行连续的颗粒监测。每个实验室都要与其他实验室完全隔离,以便用汽化过氧化氢进行熏蒸。
目前CAR-T产品常见的生产环境有两种:B+A和C+A(隔离器),需要明确的是,无论是哪种实现形式,按照无菌生产要求,所有生产环节不能离开A级环境,这就要求对无菌生产要有充分的理解,否则将面临合规性方面的挑战。
B+A是大家首先考虑的生产环境实现形式,但这种方式面临一个问题是不能保证全程在A级环境下完成。C+A是现阶段CAR-T产品无菌生产的一种理想方案。细胞制品生产过程中的隔离措施以隔离器为最佳,无菌生产的隔离器对环境的要求可以降低,而且可以将离心、培养等关键环节集成在隔离器内,实现全程的A级隔离。
在这些区域使用的材料和设备必须尽量减少颗粒物(使用洁净室级钢、其他材料等)和生物或化学污染的机会。应监测周期性好氧和厌氧微生物负荷。
 图1 GMP厂房设计
图1 GMP厂房设计
空气处理装置必须配备适当的设备,并通过书面文件、测试和定期维护对区域等级进行验证。不同等级区域的空气处理装置应根据其各自的管道而有所不同。
生产区和灌装区必须明确划分和隔离(必须保持人员和物料流动的标准操作程序)。必须将适当的颗粒计数器、微生物传感器、空气流量传感器等放置在制造设施的工作区域,并保存记录。
用于生产的洁净室区域内的所有仪器必须有校准标准操作规程,并提供定期维护的文件。设施必须定期进行空气过滤器、仪器等的维护验证,以确认指定的分类区域的维护。
工艺标准操作规程必须包括安全方法,防止污染,定期测试污染物、微粒和风险最小化的方法。生产过程中的所有数据必须在有权限访问下安全存储,并在评估过程中提供。
生产负责人应当具有相应的专业知识(如微生物学、细胞生物学、免疫学等),至少具有三年从事生物制品或细胞治疗产品生产或质量管理的实践经验。质量负责人和质量受权人应当具有相应的专业知识,至少具有五年生物制品或细胞治疗产品生产、质量管理的实践经验,从事过生物制品或细胞治疗产品质量保证、质量控制等相关工作。
从事细胞治疗产品生产、质量保证、质量控制及其他相关人员(包括清洁、维修人员)应当经过接受良好的无菌程序、污染物测试、生产过程(根据批准的标准操作规程)和维护所有过程相关文件方面的培训。尤其是预防经供体材料传播疾病方面的知识,以防止传染性疾病的病原体在物料、产品和人员之间传播以及对环境潜在的影响。
负责制造、相关工艺、包装或搬运的人员必须在制造设施内始终穿着干净、安全和适当的衣服,并保持无菌条件(应制定人员进出的标准操作规程)。必要时,应穿戴覆盖身体、头部、面部、手和手臂的防护服,以防止产品受到污染(必须制定标准操作规程)。员工必须养成良好的卫生和健康习惯。从事质粒和病毒载体制备和细胞治疗产品生产的人员不得穿越不同的生产区域。
4.1 生产流程
在设计CAR-T 细胞制造SOP时,特别建议开发一个封闭的,或功能封闭的制造过程,以降低产品污染的风险。
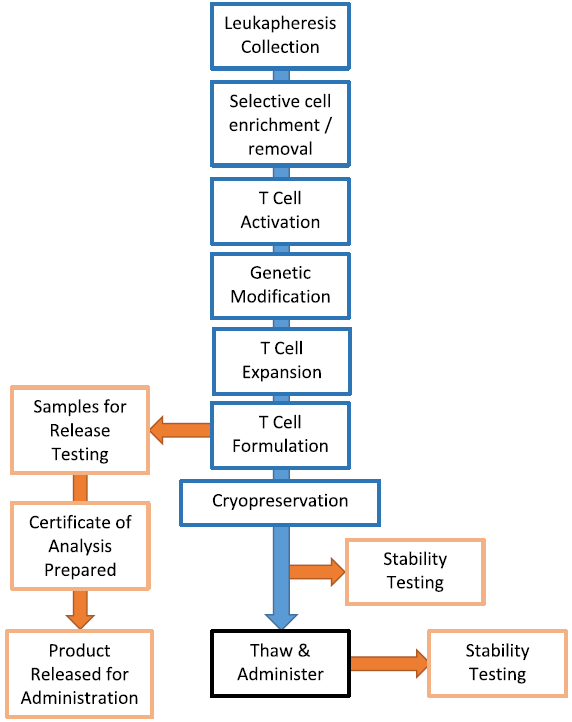 图2 CAR-T细胞生产流程
图2 CAR-T细胞生产流程
从在简单的T瓶和细胞培养袋中培养到在复杂的生物反应器中制备,理想的系统应该在功能上是封闭的,以减少污染的风险,因此,大多数研究人员已经放弃使用T形瓶。目前,应用最广泛的培养设备是G-Rex(Wilson Wolf Manufacturing)、Wave biorector(GE Life Systems)和CliniMACS Prodigy(Miltenyi Biotec)。
G-Rex专为悬浮细胞培养设计,氧气从底部透气膜渗透进入培养体系,细胞自然沉降至培养瓶底部,葡萄糖等营养物质自然对流至细胞,细胞可以用GatherRex(Wilson Wolf Manufacturing)收集至转移包中进行下游处理。
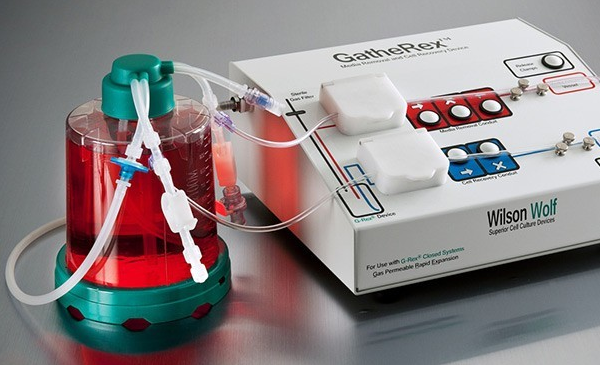 图3 符合GMP要求的CAR-T细胞生产装置G-Rex及GatherRex
图3 符合GMP要求的CAR-T细胞生产装置G-Rex及GatherRex
旭日(Wave)生物反应器是一个自动化的封闭系统,由一个放置在摇摆平台上的透气细胞培养袋组成。该系统配备流量控制器、气体压力传感器、pH、氧气和二氧化碳浓度传感器等装置。已经成功地用于生产CAR-T,该系统可用于生产1-1000升的产品。
CliniMACS Prodigy全自动多功能细胞处理系统符合欧盟GMP标准,全封闭操作系统,取代传统方案中多个人工操作环节及相应的仪器设备,轻松实现标准化、全自动CAR-T细胞制备过程,包括细胞富集、转导、洗涤和扩增,是目前应用最广泛的自动化设备。在Prodigy装置中,MACS CD4和CD8用于细胞富集,CD3/CD28试剂用于激活,慢病毒载体用于细胞转导,这些细胞在TexMACS培养基-3%HS-IL2中培养,洗涤步骤采用PBS/EDTA缓冲液。用Prodigy装置对起始细胞进行洗涤,去除血小板,富集CD4+和CD8+细胞。约10%的CD8+ NK细胞经CD3/CD28活化和扩增后大量清除。
4.2 生产控制
企业应当建立书面操作规程,规定供体材料和产品在接收、运输、生产、检验、放行、发放过程中正确标识与核对标识信息的操作和记录,确保可识别供体且具有唯一性的编号代码,不会发生标识错误或遗漏,且具有可追溯性。企业应当制定供体筛查标准,制订供体材料采集、运输、接收标准操作规程,详细说明供体材料的采集方法、保存和运输条件以及接收的标准。
产品生产过程中应当采取措施尽可能防止污染和交叉污染,如:采用含有传染性疾病病原体的自体供体材料进行生产的,其生产、转运过程中不得接触其它不含有传染性疾病病原体的供体材料或产品;未采用密闭设备、管路生产的,不得在同一区域内同时进行多个产品或多个批次的生产操作,但产品已密封的培养操作除外;采用密闭设备、管路在多条生产线上同时生产同一品种的多个批次时,应当采取有效措施规范人员、物料和废弃物的流向;在密闭条件下进行细胞培养的,同一培养箱内可同时培养和保存不同品种、不同批次的产品,但应当采取有效措施避免混淆;在非密闭条件下进行细胞培养的,同一培养箱只可培养和保存同一批次的产品。
生产过程中的中间产品和物料的转运有特殊要求的,如温度,应当对转运条件有明确的规定,并有相应的转运记录。
4.3 质量控制
应建立质量控制(QC)流程和程序,以确保最终产品的质量。QC应通过适当的检测以确保每批生产所有关键工艺步骤符合中控标准并保持无菌,并确保使用的所有物料符合规定的标准。应当建立安全、有效处理不合格供体材料、中间产品、成品、过期留样样品的操作规程,处理应当有记录。细胞治疗产品放行前的质量评价应当确认每批产品的信息完整、正确且可追溯,否则不得放行。

图4 CAR-T质控
参考文献: [1]. Gee, A. P. (2018). GMP CAR-T cell production. Best Practice & Research Clinical Haematology, 31(2), 126–134. [2].https://cdn.ymaws.com/isctglobal.org/resource/resmgr/regionalpageresources/national_guidelines_for_gene.pdf [3]. https://wenku.baidu.com/view/8ca7fbd12aea81c758f5f61fb7360b4c2e3f2a76.html