联系我们
010-69739712

CD8+ T 细胞,又被称为细胞毒性T 淋巴细胞(cytotoxic T cell, CTL)或者杀手T细胞(killer t cell),是人体适应性免疫系统的关键组成部分。他们负责杀灭被病毒和细菌感染的细胞以及癌细胞, 并形成记忆T细胞(memory T cell),为人体提供长期的保护。然而,在慢性感染和肿瘤中,T细胞长期暴露于抗原以及炎症之下,其逐渐进入一种功能失常的状态,被称为T细胞耗竭(T cell exhaustion)【1】。其主要表现为杀伤功能的丧失,多种抑制性受体的上调(包括 PD-1, Tim3, CTLA-4等等),以及增值分化能力的减退【1】。因此,预防T细胞耗竭或者逆转耗竭的T细胞,恢复T 细胞的杀伤能力,是提升临床慢性感染和肿瘤免疫治疗的关键。
目前,靶向作用于这些抑制性受体的治疗药物如Anti-PD-L1,已经被广泛应用于多种癌症,且拥有较好的治疗效果。尽管如此,只有少数病人可以达到长期的治愈,而大多数病人出现短期的肿瘤控制,但效果难以得到长期的维持。研究表明,使用免疫检查点阻断疗法后,耗竭T细胞虽然短暂恢复功能,但是无法完全恢复成细胞毒性T淋巴细胞。究其原因,在耗竭T细胞形成过程中,其表观遗传已固定,细胞命运已经被锁定【2】。
2021年7月19日,来自Versiti血液研究所, 威斯康星医学院(Medical College of Wisconsin, MCW)的Weiguo Cui团队和来自La Jolla Institute for Immunology的Patrick G. Hogan和Anjana Rao的团队同时在Nature Immunology 发表文章BATF regulates progenitor to cytolytic effector CD8+ T cell transition during chronic viral infection和BATF and IRF4 cooperate to counter exhaustion in tumor-infiltrating CAR T cells,分别在慢性感染模型和CAR T细胞治疗实体瘤的模型中,共同揭示了BATF,一个细胞转录因子(transcription factor, TF),可以阻断T 细胞耗竭之路,增强T 细胞的抗病毒与抗肿瘤的功能,为治愈慢性感染和实体瘤提供了新思路。接下来,我们将分别介绍这两个研究。

Weiguo Cui团队先前的研究及其他团队研究发现,在慢性感染和肿瘤微环境中,耗竭T细胞并非是一个统一的群体,依据细胞的功能和基因组的差异,主要可分为三个亚群:保持休眠的干细胞样祖细胞 (progenitor T cell, TPRO),终末耗竭性t细胞(exhausted T cell, TEXH),和具有一定细胞毒性的效应性T细胞 (effector T cell, TEFF)。祖细胞可以进一步分化为终末耗竭性T细胞,或者效应性T细胞【3-9】。在慢性感染和肿瘤中的研究表明,祖细胞和效应T细胞的数量和免疫治疗效果成正比【9-11】。因此,了解T细胞亚群分化的过程及其调控机制,为免疫学家编辑T细胞运用于临床慢性感染和肿瘤免疫治疗提供了更多的机会。
基于耗竭T细胞的命运难以被逆转的事实,寻求调控祖细胞向效应性T细胞分化为免疫治疗慢性感染和癌症提供了新思路。然而,哪些调节因子和信号通路调控祖细胞向效应性T细胞分化目前并不清楚, 是领域内亟需回答的问题。
Weiguo Cui团队MCW微生物与免疫系的在读博士生陈瑶及其同事揭示了, 在慢性感染病毒感染过程中,BATF是祖细胞向效应性T细胞分化的必要转录因子。
他们首先使用了SCENIC分析方法从单细胞RNA-seq数据中推断出了各T细胞亚型的基因调控网络。其中包括已知功能的转录因子,例如TCF-1调控祖细胞, Maf,Eomes,Nr4a调控耗竭T细胞。这些发现印证了SCENIC推断的有效性。更重要的是他们发现了许多可能调控效应T细胞的转录因子。这些发现为调控三群细胞的分化提供了许多新的靶点。
随后他们把重点放在解析这三群细胞的表观遗传特征。因为表观遗传景观直接决定了基因表达的活性,从而决定细胞分化的方向和逆转命运的可能性。他们用流式细胞仪分离了三群细胞 (TPRO, TEXH,TEFF),然后采用了CUT&Tag-seq(类似于传统CHiP-seq)和ATAC-seq检测了在各个细胞亚型中,基因的启动子(promotor)的活性(H3K27me3 and H3K4me3),强化因子(enhancer)的开放和活性 (ATAC-seq and H3K27ac)。
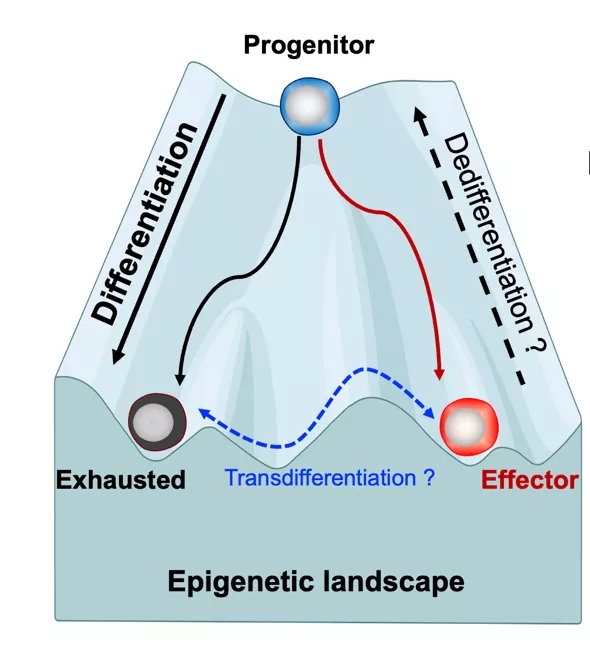
图1. T细胞亚群的表观遗传景观
他们发现,强化因子在调控与这三群T细胞分化和功能密切相关的基因表达上具有重要作用。此外,通过推断转录因子在这些强化因子区域的富集情况,他们发现BATF显著富集在祖细胞,效益T细胞,以及祖细胞和效益T细胞共有的强化因子区域。因此,他们提出假设:BATF在祖细胞向效应T细胞分化过程中起着重要作用。
接下来,为了验证BATF的功能。他们在慢性病毒感染后期,在CD8+ T中敲除BATF。他们发现,BATF缺失的T细胞向效应T细胞的分化的能力显著下降。结合其他实验, 他们证实,BATF是在祖细胞向效应T细胞分化过程中所必须的。
为了进一步探究BATF调控的机制,他们检测了BATF转录因子在三群细胞中结合DNA的情况。结果显示,BATF大量结合在效应T细胞的DNA,且BATF大量结合在祖细胞向效应T细胞分化过程中所必须的强化因子区域,从而调控所需基因表达。
综上,Weiguo Cui团队的研究系统的绘制了各T细胞亚型的基因调控网络,并详细对比了各CD8+ T细胞亚型在慢性以及急性病毒感染过程中的异同。更重要的是,他们首次从细胞和分子机制层面揭示了BATF是预防T细胞耗竭,调控祖细胞向效应T细胞的分化的重要因子。且他们揭示了BATF在表观遗传学上对这一过程的作用。这些发现对于在治疗慢性感染和癌症中,选择合适的细胞亚型和细胞分化路径作为免疫治疗的靶点,以及是否引入BATF编码用于免疫治疗的T细胞提供了参考。
CAR-T(Chimeric Antigen Receptor T cell)疗法是指,从患者体内分离出T细胞,然后在体外对T细胞进行编辑,使其表达识别癌细胞的CAR,然后将这些CAR-T细胞扩增后,回输到患者体内,杀灭癌细胞,从而发挥抗癌作用的细胞免疫治疗方式。目前,CAR-T疗法已经运用于治疗血液学肿瘤,例如急性淋巴细胞白血病和一些非霍奇金淋巴瘤,并具有显著的治愈效果【12】。然而,CAR-T治疗实体瘤领域,表现却不尽如人意。其中一个重要的原因是,CAR-T回输到患者体内后,倾向于变成“耗竭”状态【12】。因此,如何阻断CAR-T的耗竭之路,是提升CAR-T临床治疗实体瘤效果的关键。
来自Patrick G. Hogan和Anjana Rao团队的Hyungseok Seo及其同事研究发现, BATF可以阻断CAR-T细胞的耗竭,使CAR-T细胞具有更强的增值能力和较高的细胞毒性,并产生长期的肿瘤抑制效果。

首先,他们通过分析已有的Bulk RNAseq 数据库,筛选出几个与增强T细胞功能相关的候选转录因子,包括Jun,Maff,BATF。随后,他们将过表达这些转录因子的anti-hCD19 CAR-T细胞回输给有B16F0-hCD19 肿瘤的老鼠。他们发现,BATF过表达的CAR-T具有最好的肿瘤治愈效果,使得小鼠肿瘤显著减小,存活地更久。其中5只老鼠,他们的肿瘤完全消失。
通过分离分析这些肿瘤浸润的CAR-T细胞,他们发现,过表达BATF显著增强了CAR-T的增值能力和细胞毒性。有效预防T细胞耗竭。
接下来,他们检测BATF过表达的CAR-T细胞是否具有长期的肿瘤抑制效应。他们将之前5只肿瘤完全治愈的老鼠重新植入同一种肿瘤细胞,他们发现,肿瘤细胞无法在这些治愈的老鼠身上生长,说明BATF过表达的CAR-T细胞形成了记忆细胞,可以提供长期的保护,防止肿瘤复发。
他们进一步探究BATF阻断T细胞耗竭的机制。他们发现,另一个转录因子,IRF4是BATF阻断T细胞耗竭所必须的共同调控因子。虽然前期研究表明,IRF4 促进T细胞耗竭。那么关于 IRF4这看似冲突的角色后隐藏着哪些调控机制?
接下来,他们通过检测BATF和IRF4 在WT和BATF过表达细胞中结合DNA的情况(CHiP-seq),发现,过表达BATF抑制IRF4在细胞激活前期上调, 并使IRF4更倾向于与BATF一起结合在亲和力更高的AICE 结合点,从而调控T细胞效应相关的基因。IRF4 此外,他们还发现,BATF和IRF4结合在这些区域,提高了染色质的可进入性(chromatin accessibility),从而促进基因表达。
综上,Patrick G. Hogan和Anjana Rao的团队首次揭示了,在实体瘤中,过表达BATF可以阻断CAR-T细胞的耗竭,增强CAR-T细胞的增值能力和细胞毒性,并形成记忆细胞,提供长期的肿瘤治疗效果。他们的研究为在设计CAR-T细胞时引入转录因子预防T细胞耗竭提供了借鉴, 为提高CAR-T在实体瘤临床治疗的研究中提供了新思路。
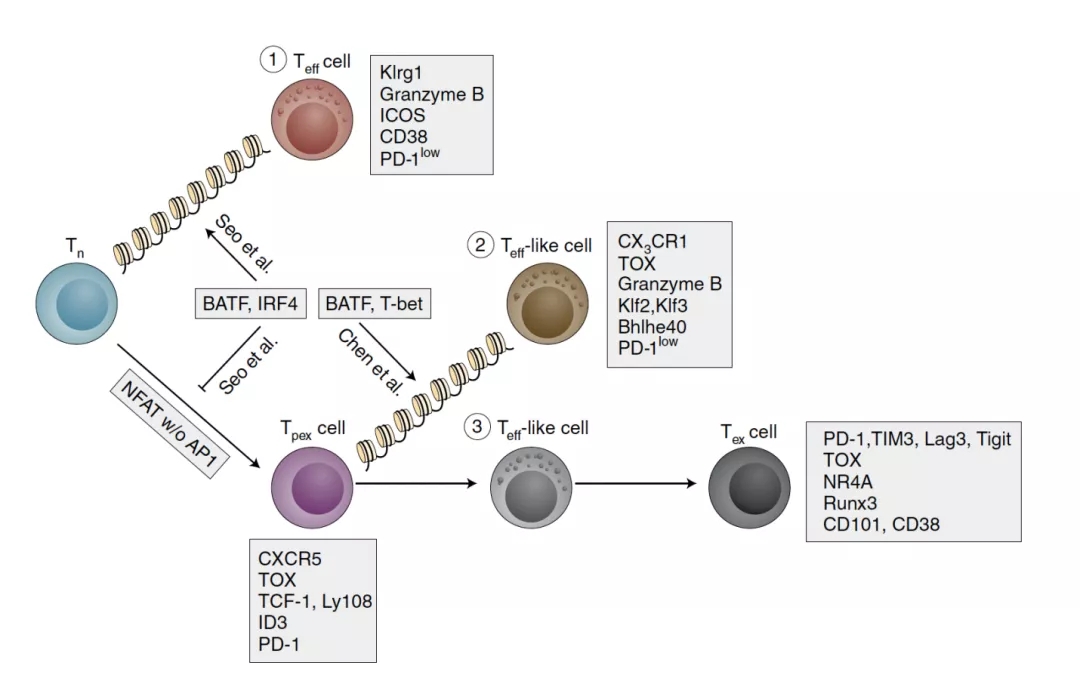
图2. BATF调控CD8+ T 细胞分化(Shannon K. Boi, Xin Lan and Ben Youngblood, Nature Immunology,news&views,2021)
上述两篇文章,分别在慢性病毒感染和CAR T细胞治疗实体瘤的模型中揭示了,BATF可以在表观遗传上阻断T细胞耗竭之路,并引导祖细胞向效应T细胞的分化。这一发现提供了一条细胞免疫治疗的新思路:预防耗竭细胞分化而非逆转已经耗竭的T细胞。
祖细胞因其具有较高的细胞可塑性,被认为最具潜力的细胞免疫治疗肿瘤和慢性炎症的靶点。然后,前期研究表明,Anti PD-L1等治疗手段只能增强祖细胞的自我复制,而不能引导祖细胞向具有细胞毒性的效应T细胞分化【9】。CD4+ T细胞分泌的IL-21 是Anti PD-L1 引导祖细胞向效应T细胞分化的必要因素【9,13】。然而,在HIV等慢性感染以及肿瘤微环境中,CD4+ T细胞的辅助功能失调,无法为CD8+ T细胞提供有效的帮助【14,15】。BATF被认为是IL-21信号通路主要的下游转录因子【16】,因此,以BATF为靶点编辑T细胞可以绕过对CD4+ T-IL-21的需求,直接阻断祖细胞向耗竭T细胞分化的可能,促进其向效应T细胞分化。从而增强T细胞抗病毒和杀灭癌细胞的能力。
综上,调节因子和信号通路调控祖细胞向耗竭T细胞或效应性T细胞分化目前仍有待进一步的研究。例如BATF与不同调节因子之间的相互作用;BATF在表观遗传学上的调控机制等等。
参考文献:
1 Wherry, E. J. & Kurachi, M. Molecular and cellular insights into T cell exhaustion. Nat Rev Immunol 15, 486-499, doi:10.1038/nri3862 (2015).
2 Pauken, K. E. et al. Epigenetic stability of exhausted T cells limits durability of reinvigoration by PD-1 blockade. Science 354, 1160-1165, doi:10.1126/science.aaf2807 (2016).
文章来源: BioArt